Tecniche di osservazioni in microscopia ottica - Seconda parte: fluorescenza
Data la particolare complessità di questi sistemi, dedicheremo in tre parti ogni singola metodica iniziando dalla Fluorescenza. Questi sistemi sono complessi dal punto di vista ottico/meccanico ma in realtà il loro utilizzo risulta piuttosto semplice.
Come descritto nella prima parte delle tecniche di osservazione in microscopia, i preparati si dividono principalmente in quattro categorie:
- Preparato colorato. Fissato su vetrino.
- Istologia, citologia, ematologia, sezioni sottili (trasparenti) di materiali, petrografia (trasparenti).
- Preparato non colorato. Fissato su vetrino.
- Fibre d’amianto, sezioni biologiche non colorabili, tessuto nervoso, microrganismi, batteri.
- Preparati in vivo, colture cellulari, microorganismi. Generalmente questi campioni sono contenuti in appositi supporti, piastre, fiasche e vengono osservati con il microscopio di tipo rovesciato.
- Preparati colorati con opportuni coloranti fluorescenti sia fissati che in vivo.
La Fluorescenza, è una metodica molto sofisticate dal punto di vista ottico. Gli elementi che ne compongono il sistema sono integrabili su microscopi predisposti all’uso dei componenti dedicati. Per questo è importante richiedere le informazioni specifiche alle vostre esigenze per capire la giusta configurazione.
FLUORESCENZA
Preparato colorato con specifici marcatori, fissato su vetrino o in colture cellulari
Questa metodica ormai molto diffusa consente di “marcare” uno o più componenti d’interesse con delle molecole fluorescenti detti fluorocromi. É una tecnica molto diffusa nei laboratori di microbiologia in immunofluorescenza per la ricerca ad esempio di batteri, nell’osservazione di cellule, in citogenetica per l’osservazione di cromosomi, ma anche per osservare vegetali (che sono auto-fluorescenti), nell’industria per osservazioni di fibre naturali ed in alcuni casi per l’osservazione di micro saldature.
L’utilizzo dei fluorocromi è specifico per la marcatura e osservazione principalmente di preparati biologici.
Ma quale è il principio su cui si basa questa tecnica?
I fluorocromi hanno una caratteristica molto particolare. Ognuno di questi se colpito da una radiazione luminosa specifica emette a sua volte luce con lunghezza d’onda superiore di quella assorbita che quindi evidenzierà il componente marcato con precisione. Ad esempio il fluorocromo FITC se colpito da una radiazione blu (490 nm) emetterà una radiazione verde (520 nm).
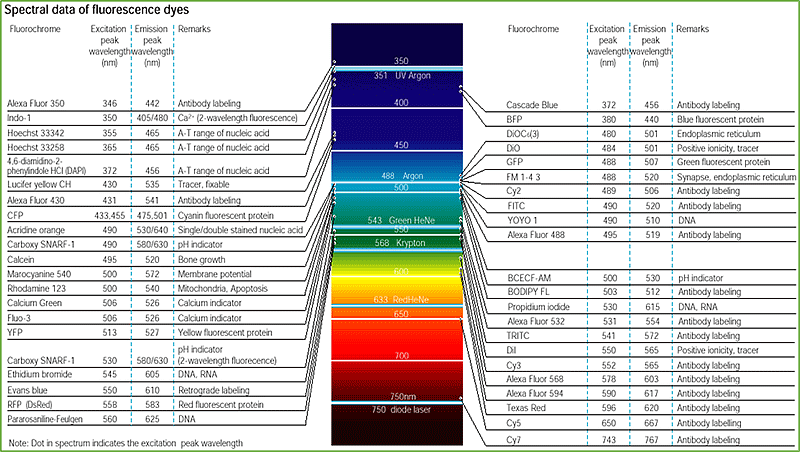
Come si può notare dalla tabella, ogni singolo fluorocromo ha una specifica lunghezza d’onda con il quale deve essere illuminato ed una specifica di emissione. Inoltre questi fluorocromi sono “specializzati” per legarsi a particolari componenti biologici.
Oggi il sistema di illuminazione per la fluorescenza si utilizza in epi-illuminazione cioè con luce incidente e non in luce trasmessa. Questo per avere il massimo del segnale luminoso emesso dal fluorocromo.
Il dispositivo viene collocato tra lo stativo del microscopio ed il tubo d’osservazione. È un dispositivo separato che spesso si può aggiungere allo stativo di un microscopio già in uso in modo piuttosto semplice. In questo caso è però necessario valutare la qualità degli obiettivi per essere certi che possano essere adeguati a questa metodica.
Esistono diverse possibilità di setup per questa metodica a partire dalla illuminazione che si più scegliere tra diverse soluzioni.

La sorgente luminosa più utilizzata è la lampada a vapori di mercurio HBO ad alta pressione. Esiste in due versioni: da 50 o 100W. Meno utilizzata la lampada allo Xenon XBO generalmente di 200W di potenza.
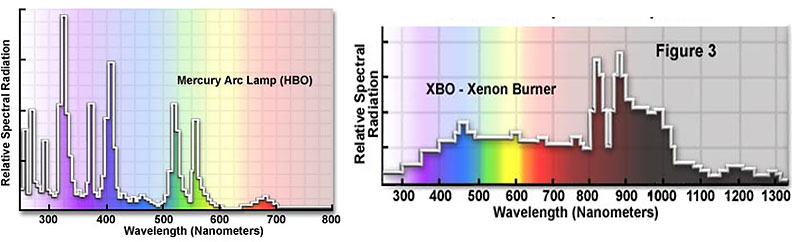
La scelta va fatta in funzione delle applicazioni e dei preparati che si vogliono esaminare. Questo dipende sia dall’energia che la lampada emette sia rispetto ai picchi di massima energia sulle specifiche lunghezze d’onda. In generale le lampade HBO 100W sono in grado di soddisfare le principali applicazioni tra le più difficili quali ad esempio l’osservazione di cromosomi marcati per il centromero, per il telomero o per locus specifiche.

Esistono anche soluzioni che adottano tecnologie nuove: i LED.
In questo caso la sorgente è costituita da un LED con una specifica lunghezza d’onda di emissione. Il LED è corredato da una serie di filtri che ottimizzano la lunghezza d’onda specifica.
Anche questo tipo di soluzione viene inserito tra microscopio e tubo di osservazione con semplicità.
In generale si possono utilizzare fino a quattro LED posizionati su una slitta che ne consente l’inserimento nel percorso ottico.
I sistemi a LED hanno il vantaggio di essere semplici nell’utilizzo è hanno una vita più lunga rispetto ad una lampada HBO. Per contro l’energia emessa è più bassa e quindi non possono essere usati su campioni che necessitano molta energia di eccitazione. Questo è un motivo di scelta che deve essere discusso con il vostro referente tecnico.
Quali sono i componenti ottico/meccanico che compongono il sistema?
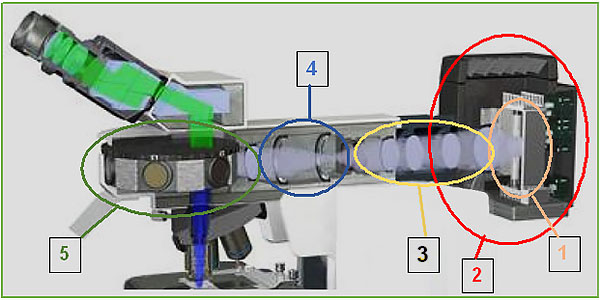
1. Lampada HBO / XBO
2. Corpo lampada
3. Sistema ottico di illuminazione
4. Diaframma di Campo e Diaframma di Apertura
5. Torretta (Revolver) porta filtri
Il corpo lampada è equipaggiato con dei sistemi meccanici a vite che consentono di allineare la lampada rispetto al percorso ottico di illuminazione. Questa operazione è fondamentale per avere la massima intensità di illuminazione ed energia sul preparato.
Il “cuore” di questo sistema di illuminazione è il gruppo di filtri che servono a selezionare la giusta lunghezza d’onda di eccitazione.
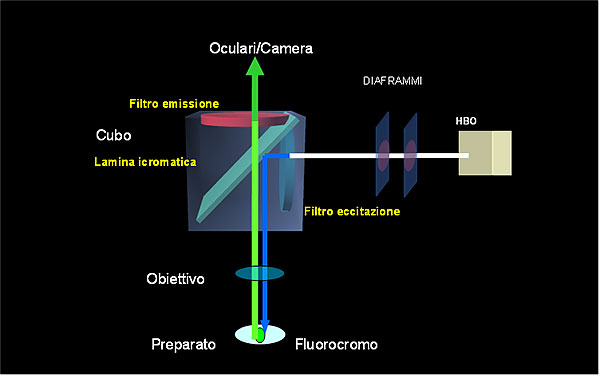
- Filtro di eccitazione. È il primo elemento che la luce emessa dalla lampada incontra nel suo percorso. Questo filtro serve a selezionare la lunghezza d’onda che serve per il fluorocromo utilizzato. Nell’esempio grafico potremmo assumere di aver utilizzato il fluorocromo FITC che si attiva con una lunghezza d’onda di 490 nm (blu) e emette a 520 nm (verde). Quindi questo filtro avrà il compito di selezionare la lunghezza d’onda specifica.
- Lamina dicromatica. Questo elemento ha una costruzione ottica particolare. Grazie a depositi di sistemi di antiriflesso sulla superfice del filtro questo è in grado di riflettere una certa lunghezza d’onda e di trasmetterne altre con valore superiore. Nel caso descritto, dopo che la luce ha attraversato il filtro di eccitazione (490 nm), verrà riflesso verso l’obiettivo e raggiungerà il preparato. L’emissione del fluorocromo attraversa nuovamente l’obiettivo e incontrando nuovamente la lamina dicromatica. Questa radiazione (520 nm) sarà trasmessa verso il terzo elemento.
- Filtro di emissione o di sbarramento. La natura del preparato, il metodo di colorazione e/o di lavaggio possono influire sulla qualità di emissione generando a volte un fondo colorato che disturba l’osservazione degli elementi che sono stati marcati. Il filtro di sbarramento ha la funzione di eliminare questa problematica rendendo l’immagine con un fono di colore nero per mettere in maggiore risalto solo gli elementi di interesse. Questo filtro può essere più o meno selettivo e dipende dal tipo di preparato e fluorocromo utilizzato.
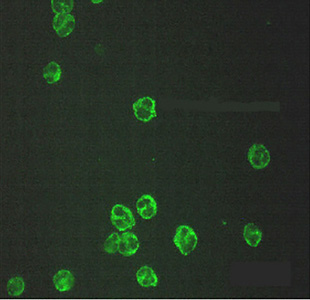
Filtro sbarramento poco selettivo
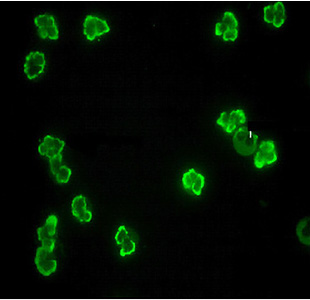
Filtro sbarramento selettivo

In commercio questi gruppi di filtri sono già assemblati e suddivisi per gli specifici fluorocromi. Inoltre per la stessa tipologia di fluorocromi esistono filtri più o meno selettivi che consentono quindi una ampia scelta di soluzioni.
Questa metodica è stata nel tempo sviluppata sia in termini di set di filtri sempre più precisi nella selezione della lunghezza d’onda, sia nello sviluppo di obiettivi dedicati all’utilizzo in fluorescenza. Alcune aziende offrono set di filtri che hanno al loro interno dei sistemi di assorbimento che permettono di eliminare fino al 99% della luce residua che porterebbe a un fondo del preparato non perfettamente nero
Quando l’emissione del segnale di fluorescenza è molto debole o quando è necessario avere un segnale estremamente definito si possono utilizzare obiettivi appositamente dedicati all’osservazione di preparati in fluorescenza. Molti vetri che si utilizzano nella costruzione degli obiettivi hanno un residuo di auto-fluorescenza. Per questo alcuni obiettivi in commercio sono costruiti con vetri che diminuiscono eventuali problemi di auto-fluorescenza restituendo un segnale estremamente “pulito”.
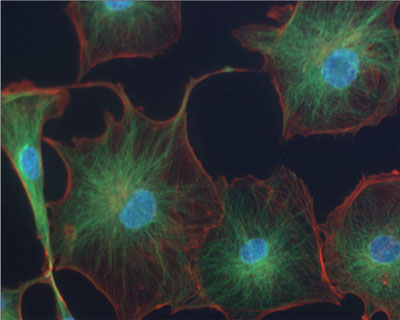
Le marcature multiple di differenti fluorocromi sullo stesso preparato consentono di individuare contemporaneamente diverse strutture.
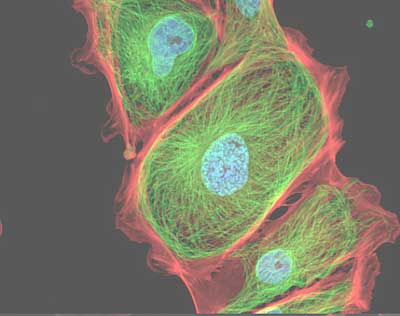
Un caso tipico è quello della colorazione con tre fluorocromi differenti che consenta di individuare ad esempio il nucleo il citoplasma e lo scheletro di una cellula.
È possibile ad esempio colorare i nuclei con il fluorocromo DAPI, il citoplasma con il fluorocromo FITC e lo scheletro con il fluorocromo TRITC.
L’emissione del DAPI e di colore blu con eccitazione in UV, il FITC emette in verde con eccitazione in blu e il TRITC emette in rosso con eccitazione in verde.
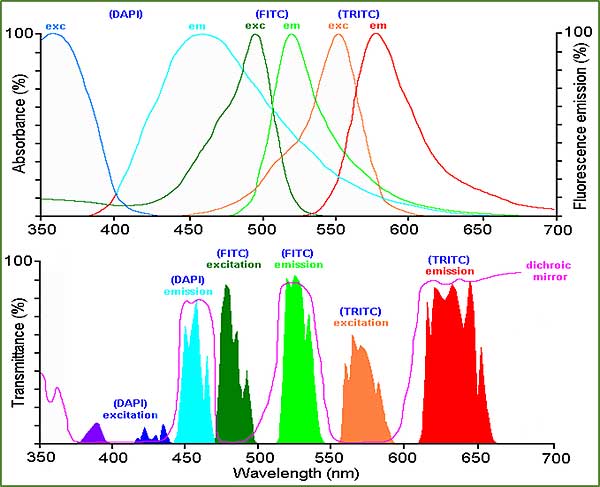
Come si può vedere dai grafici di eccitazione ed emissione non ci sono interferenze tra le tre marcature.
Per poter osservare questi preparati con multi marcatori esistono due tecniche di osservazione. Una che utilizza filtri multipli, una che utilizza filtri singoli e un software che consenta la gestione delle immagini acquisite.
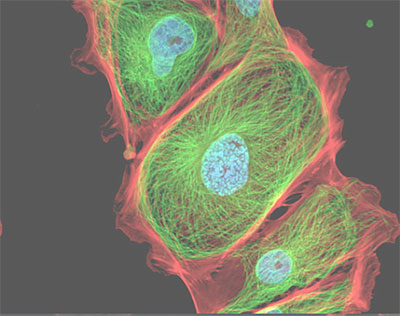
L’utilizzo dei filtri per multi marcature ha il beneficio di vedere agli oculari del microscopio i tre o più colori contemporaneamente e quindi di avere immediatamente un’immagine completa.
Purtroppo la complessità costruttiva di questi set di filtri ha dei limiti. Le curve di emissione delle singole emissioni non sono quasi mai iper-selettive. Succede in molti casi che la “coda” di emissione del primo colore sconfini nella parte del secondo e così con i successivi. Questo determina che i segnali non siano perfettamente separati e quindi a volte non bene distinguibili. Inoltre il fondo non risulta quasi mai nero per dare il contrasto migliore. Tuttavia questi filtri sono utilizzati proprio per avere un’informazione complessiva e veloce direttamente all’osservatore senza particolari altre complicazioni tecniche.
La seconda tecnica consente di avere dei risultati di altissima qualità ma serve nel setup del microscopio una telecamera in B/W ed un software per la ricostruzione dell’immagine.
Il metodo consiste nell’utilizzare per ogni singolo fluorocromo un filtro specifico altamente selettivo. Questo permetterà di acquisire tramite la telecamera immagini ad alta risoluzione.
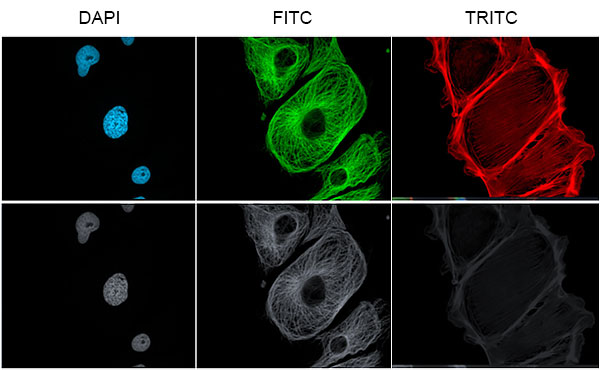
È preferibile usare una telecamera B/W perché hanno sensibilità di acquisizione molto più alte rispetto alle telecamere a colori e soprattutto, una maggiore definizione dell’immagine finale. Le singole immagini acquisite verranno modificate con degli pseudo colori e successivamente sovrapposte per ottenere l’immagine finale
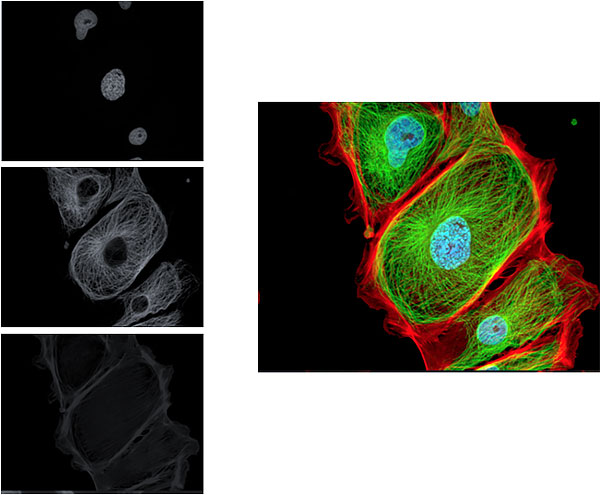
Con filtro per multi marcatura
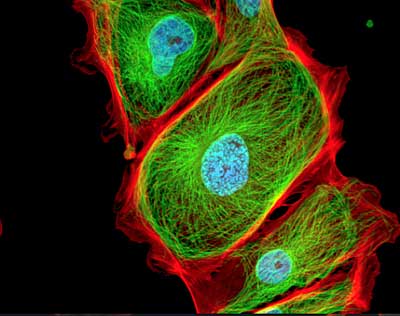
Con filtri singoli e modifiche con SW
Nella terza parte di questo capitolo sulle metodiche di osservazione affronteremo le tecniche di contrasto DIC e HMC.
Come scegliere la giusta applicazione per i vostri campioni in fluorescenza?
Sintak s.r.l. può aiutarvi nella giusta scelta dei componenti in base alle vostre esigenze e definire il miglior setup per il vostro microscopio in fluorescenza: sistema di illuminazione, filtri, obiettivi e/o compatibilità con il vostro microscopio dei sistemi presenti nel mercato.
Per questo vi invitiamo a contattarci per approfondire la scelta migliore per voi.
Potete rivolgervi e scrivere a:


