Tecniche di osservazioni in microscopia ottica - Terza parte
In generale queste tecniche vengono utilizzata sia su microscopi dritti che rovesciati. La scelta d’uso dipende essenzialmente dal tipo di preparato.
Come descritto nella prima parte delle tecniche di osservazione in microscopia, i preparati si dividono principalmente in colorati, non colorati, in vivo:
Microscopio dritto
Preparati non colorati su vetrino. Sezioni biologiche non colorabili, tessuto nervoso, microrganismi, batteri, campioni per Patch-Clamp in elettrofisiologia.
Microscopi rovesciati
Preparati in vivo, colture cellulari, microorganismi. Utilizzati nelle tecniche di ICSI (Intra Cytoplasmic Sperm Injection). Generalmente questi campioni sono contenuti in appositi supporti, piastre, fiasche.
DIC Differential Interference Contrast (Nomarski)
Georges Nomarski nasce il 6 gennaio 1919 a Nowy Targ in Polonia.
A metà degli anni ’50 Nomarski inventa e mette a punto questa tecnica innovativa.
Questo metodo viene utilizzato per preparati, vivi o fissati che contengono poco o nessun contrasto ottico quando visualizzati in campo chiaro.
Questo sistema ottico relativamente complesso produce un’immagine dove l’oggetto, se incolore e trasparente, appare in bianco e nero su sfondo grigio. Migliora il contrasto creando ombre artificiali, come se l’oggetto fosse illuminato lateralmente con una visione tipo 3D.
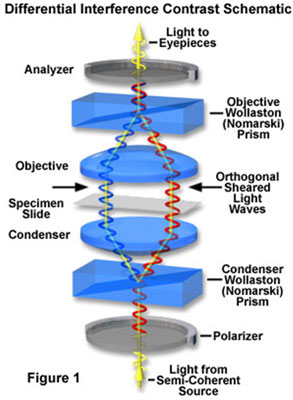
Il procedimento teorico di questo metodo è abbastanza complesso, la luce proveniente della sorgente di illuminazione viene fatta passare attraverso un polarizzatore situato sotto il condensatore, in modo simile alla microscopia a luce polarizzata.
La luce polarizzata quindi passa attraverso un prisma di Wollaston al di sotto del condensatore che divide il fascio di luce in due fasci che viaggiano in direzioni leggermente diverse, con asse di vibrazione perpendicolari tra loro, e quindi non in grado di ricombinarsi per causare interferenze.
La distanza tra i due fasci è sempre inferiore alla capacità di risoluzione dell’obiettivo, questo per evitare la comparsa di immagini doppie.
I fasci di luce, divisi, passano attraverso il campione dove i loro percorsi sono alterati causa il diverso spessore del preparato e il suo indice di rifrazione. Quando i raggi paralleli entrano nell’obiettivo, vengono concentrati al di sopra del piano focale, dove viene posizionato un secondo prisma Wollaston che ricombina i due fasci in una distanza definita al di fuori del prisma. Il secondo prisma serve a eliminare la distanza tra i due raggi e la differenza di percorso originale tra la coppia di raggi.
Tuttavia, i raggi paralleli non hanno più la stessa lunghezza a causa dei cambi di percorso causati dal campione. Al fine di far interferire i raggi paralleli l’uno con l’altro, le vibrazioni dei raggi di lunghezza diversa devono essere portati sullo stesso piano e asse. Ciò si ottiene inserendo un secondo polarizzatore (analizzatore) sopra il prisma superiore Wollaston.
La Microscopia DIC fa apparire luminoso (o colorato) un lato dell’oggetto, mentre l’altro appare più scuro (o di un colore diverso). Questo effetto ombra conferisce un aspetto pseudo tridimensionale al modello, ma non è una rappresentazione fedele della geometria del campione, perché si basa su uno spessore ottico.
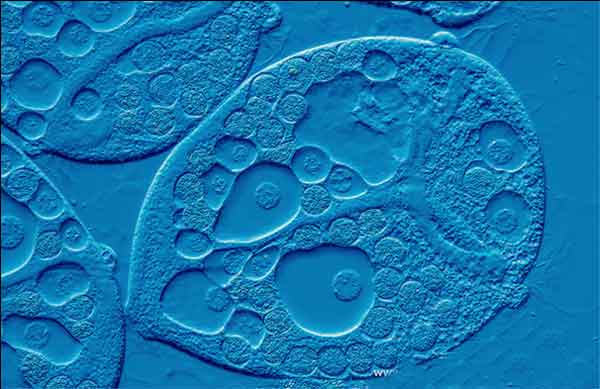
L’aspetto pseudo tridimensionale del campione può essere anche profondamente influenzato dalla sua posizione, la rotazione, cioè, del campione di 180 gradi può cambiare una collina in una valle o viceversa. Pertanto, la microscopia DIC non è adatta per la misurazione precisa dell’ altezza e della profondità reale del soggetto.
Tuttavia questo sistema di illuminazione permette di avere un gran numero di informazioni sulla morfologia del preparato osservato. Come nel caso di queste immagini di Diatomee e cellule epiteliali è facile riconoscere strutture altrimenti non osservabili in campo chiaro o in contrasto di fase.
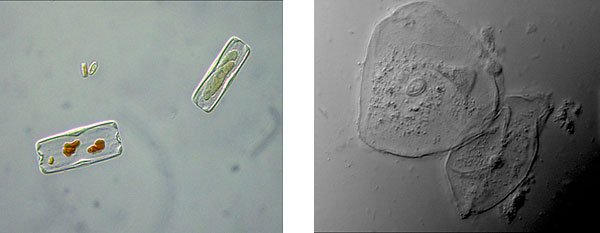
Un esempio di diatomee viste in contrasto di fase (sinistra) e in DIC (destra)*.
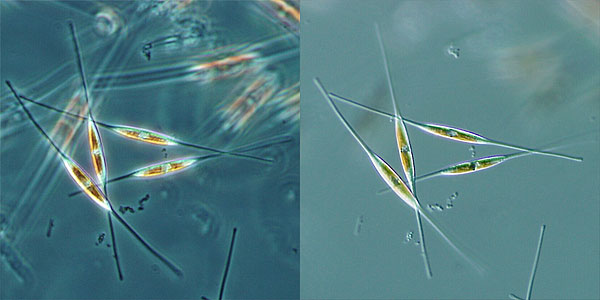
*Fonte Wikipedia
Si nota come nell’immagine di destra le informazioni legate alla morfologia grazie alla tridimensionalità siano molto più ricche di informazioni rispetto al contrasto di fase.
Gli elementi ottici che servono per l’utilizzo del microscopio per una tecnica DIC sono molti.
È necessario utilizzare un condensatore dedicato che accetta i prismi di Wollaston (uno per ogni obiettivo utilizzato), la slitta con il prisma di Wollaston regolabile ed i polarizzatori. È importante ricordare che questa tecnica ottiene i risultati migliori quando il supporto del campione è di vetro. Nel caso di plastiche vedremo che il sistema HMC permette una migliore qualità dell’immagine.

HMC Hoffman Modulation Contrast
Anche in questo caso l’aspetto 3D potrebbe essere fuorviante, poiché un elemento che sembra proiettare un’ombra potrebbe non avere necessariamente una geometria fisica distinta corrispondente all’ombra. La tecnica è particolarmente adatta per il sezionamento ottico ad ingrandimenti medio alti.
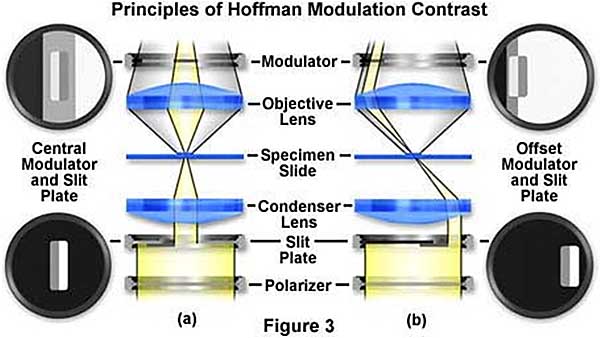
Come nel caso dei sistemi DIC anche il sistema HMC comporta l’utilizzo di molteplici componenti ottici.
A differenza del sistema DIC dove si usano obiettivi di alta apertura numerica ma standard come costruzione ottica, nel sistema HMC si devono usare obiettivi dedicati.
Questi hanno al loro interno un elemento con una zona polarizzata coniugata otticamente con il polarizzatore a diaframma posto nel condensatore.

Come nel caso dei sistemi DIC anche il sistema HMC comporta l’utilizzo di molteplici componenti ottici.
A differenza del sistema DIC dove si usano obiettivi di alta apertura numerica ma standard come costruzione ottica, nel sistema HMC si devono usare obiettivi dedicati.
Questi hanno al loro interno un elemento con una zona polarizzata coniugata otticamente con il polarizzatore a diaframma posto nel condensatore.
I sistemi HMC sono tipicamente costituiti da un condensatore con apertura a fessura, un obiettivo con apertura a fessura e un polarizzatore montato tra il condensatore e la sorgente di illuminazione utilizzato per controllare il grado di contrasto.
Il principio dell’HMC viene utilizzato da numerosi produttori di microscopi che hanno introdotto le proprie varianti della tecnica.
Questa tecnica è stata sviluppata soprattutto per i microscopi rovesciati dove i supporti dei campioni sono prevalente plastici e dove il DIC non ha grandi performance.
Il risultato dell’immagine utilizzando i sistemi HMC sono simili a quelli che si ottengono con il DIC.
Tridimensionalità dell’immagine e percezione dello spazio sull’asse Z.
Per questo motivo l’HMC è utilizzato nelle tecniche di fecondazione assistita ICSI (Intra Cytoplasmic Sperm Injection) e IMSI (Intracytoplasmic Morphologically Selected Sperm Injection)Per questo motivo l’HMC è utilizzato nelle tecniche di fecondazione assistita ICSI (Intra Cytoplasmic Sperm Injection) e IMSI (Intracytoplasmic Morphologically Selected Sperm Injection)
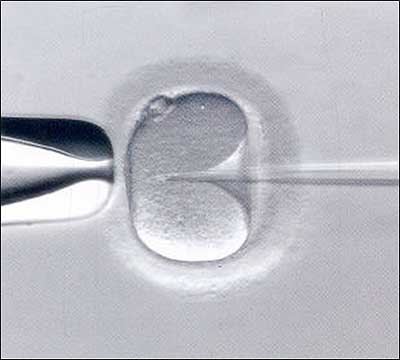
Nelle tecniche ICSI dopo la raccolta dello spermatozoo è fondamentale avere un’immagine che consenta di identificare tutti i piani di lavoro.
Dal trattenimento dell’ovocita nella giusta posizione al corretto inserimento dell’ago per il rilascio dello spermatozoo.
HMC consente di potere avere un quadro assolutamente realistico del campo operatorio.
La naturale evoluzione dell’ICSI e l’utilizzo di questi componenti permette di evidenziare ad alto ingrandimento gli spermatozoi in una tecnica chiamata IMSI.
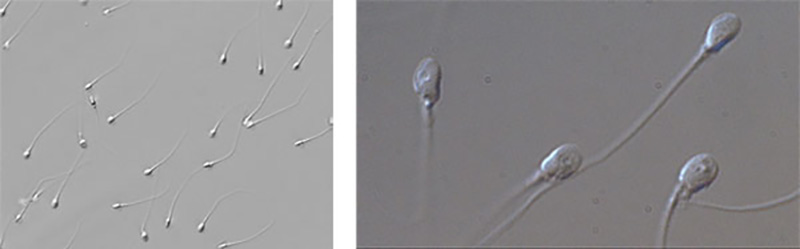
L’IMSI consiste essenzialmente in una metodica ICSI in cui però lo spermatozoo viene selezionato morfologicamente mediante una specifica strumentazione che consente di visualizzarlo, anziché ai 200/400 ingrandimenti con cui viene selezionato nella tecnica ICSI, ad un ingrandimento fino a 6600 volte maggiore. L’IMSI ha quindi lo scopo di identificare particolari alterazioni morfologiche dello spermatozoo, come la presenza di vacuoli, che potrebbero influenzare l’impianto degli embrioni, la loro qualità, le percentuali di aborto ed in ultima analisi le percentuali delle nascite.
Come detto in precedenza le tecniche DIC sono prevalentemente utilizzate su microscopi dritti e con porta campioni in vetro, la tecnica HMC viene utilizzata su microscopi rovesciati e con porta campioni plastici. Anche se nel caso delle applicazioni IMSI si stanno utilizzando da tempo piastre plastiche con fondo in vetro per migliorare il più possibile la qualità delle immagini.
In ultima analisi le tecniche di osservazione DIC o HMC sono destinate ad una osservazione prettamente morfologica dove avere una immagine 3D aiuta l’operatore ad individuare meglio gli aspetti del preparato non altrimenti visualizzabili con altre tecniche.
Ovviamente i prismi di Wollaston ed i polarizzatori possono avere dei limiti nella loro capacità di trasmittanza. In alcune applicazioni dove si utilizza luce IR, si devono adottare altre soluzioni e/o componenti dedicati per IR.
Queste tecniche posso inoltre essere associate ad altre contemporaneamente come nel caso di un utilizzo di marcature fluorescenti e DIC che consentono di vedere specifici locus all’interno di una morfologia 3D.
Nella quarta ed ultima parte di questo capitolo sulle metodiche di osservazione affronteremo le tecniche di microscopia in luce polarizzata.
In che modo scegliere la giusta applicazione per i vostri campioni?
Come sempre Sintak s.r.l. può aiutarvi nella giusta scelta dei componenti in base alle vostre esigenze e definire il miglior setup per il vostro microscopio per le metodiche di osservazioni in interferenza.
Per questo vi invitiamo a contattarci per approfondire la scelta migliore per voi.
Potete rivolgervi e scrivere a:


